A sustainable model for antibiotics
我們?cè)撊绾瓮苿?dòng)制藥行業(yè)研發(fā)出對(duì)抗耐藥性細(xì)菌的新藥呢?
盡管耐藥性細(xì)菌感染的患病率出現(xiàn)了驚人的增長(zhǎng),但是在過(guò)去十年里獲得審批的新抗生素的數(shù)量卻遠(yuǎn)遠(yuǎn)低于20世紀(jì)80年代高峰期時(shí)的抗生素?cái)?shù)量。而對(duì)于嚴(yán)重的革蘭氏陰性細(xì)菌感染而言,情況尤其令人擔(dān)憂:現(xiàn)代抗生素已經(jīng)無(wú)法治療某些革蘭氏陰性細(xì)菌感染了。而無(wú)法治療的細(xì)菌感染正在變成醫(yī)院和衛(wèi)生保健機(jī)構(gòu)中的日常現(xiàn)象,在中低收入國(guó)家中尤其如此。人們?cè)絹?lái)越認(rèn)識(shí)到了這個(gè)問(wèn)題的嚴(yán)重性,因此在大西洋兩岸發(fā)起了大量的政府和民間倡議活動(dòng)。為了更有效地應(yīng)對(duì)新出現(xiàn)的耐藥性問(wèn)題所造成的威脅,我們必須增加創(chuàng)新性抗生素的研發(fā)數(shù)量,并且利用診斷技術(shù)的發(fā)展來(lái)保持抗生素的療效。
獲得批準(zhǔn)的新抗生素?cái)?shù)量太少——這只是問(wèn)題的冰山一角而已。抗生素研究的創(chuàng)新程度遠(yuǎn)遠(yuǎn)落后于其它疾病的研究領(lǐng)域,例如腫瘤學(xué)研究,因?yàn)檫@些領(lǐng)域的研究者通過(guò)闡明相關(guān)的信號(hào)轉(zhuǎn)導(dǎo)通路,已經(jīng)研發(fā)了出更有效的、耐受性更好的治療方法,并且他們最近對(duì)免疫學(xué)有了更深入的了解,從而能向患者提供可拯救生命的免疫療法。為了促使抗生素的研發(fā)取得類似的創(chuàng)新性突破,我們需要采取一系列糾正措施,重新激起人們對(duì)基礎(chǔ)研究的關(guān)注,為創(chuàng)新性藥物的發(fā)現(xiàn)工作提供基礎(chǔ),并輔助臨床實(shí)踐的發(fā)展。
我們可以通過(guò)致病菌的基礎(chǔ)研究來(lái)更好地了解病原體,以便研發(fā)出新的治療藥物,但是這類研究卻遭受到了長(zhǎng)期資金不足和短期被人關(guān)注的雙重打擊。雖然人們經(jīng)常以HIV/AIDS為例,來(lái)說(shuō)明制藥業(yè)的創(chuàng)新行為如何改善一種疾病的發(fā)病情況,但是HIV/AIDS等重大疾病的研究資金卻嚴(yán)重不足,已經(jīng)限制了新知識(shí)的產(chǎn)生。其次,生物科技公司和制藥公司所生產(chǎn)的新抗生素?cái)?shù)量極少,從而促使大量的學(xué)術(shù)實(shí)驗(yàn)室和研究機(jī)構(gòu)開始從事藥物研發(fā)相關(guān)的工作,例如化合物庫(kù)的篩選,或者優(yōu)化先導(dǎo)化合物的結(jié)構(gòu),使其具有抗菌作用和類藥性。一些研究基金為了彌補(bǔ)制藥公司退出藥物研發(fā)領(lǐng)域后所留下的缺口,向?qū)W術(shù)實(shí)驗(yàn)室和研究機(jī)構(gòu)的藥物研發(fā)工作提供了大量資助。然而這種情況并不利于致病菌的創(chuàng)新性基礎(chǔ)研究。
藥物研發(fā)行業(yè)一直都嚴(yán)重缺乏可用于發(fā)現(xiàn)抗菌藥物的新知識(shí)和新技術(shù);事實(shí)上在過(guò)去的30年里,只有兩類新的全身性抗生素被投入了市場(chǎng)。盡管研究者投入了大量的精力對(duì)小分子庫(kù)和常規(guī)的天然藥物進(jìn)行了篩選,但是事實(shí)證明,發(fā)現(xiàn)具有新作用方式的抗生素——這是一個(gè)艱巨的科學(xué)挑戰(zhàn)。
Payne等人發(fā)現(xiàn),對(duì)化合物庫(kù)進(jìn)行高通量的藥物篩選,本身就不太可能為其它疾病的治療藥物提供起點(diǎn),更不可能會(huì)為抗生素研發(fā)項(xiàng)目提供研究的起點(diǎn)了。我們?cè)诎⑺估抵扑幑荆ˋstraZeneca)的親身經(jīng)歷類似于Payne等人的體驗(yàn),但也有些許的不同。為了尋找先導(dǎo)性抗生素,我們?cè)?001年至2010年間,利用各種化合物庫(kù)進(jìn)行了65次高通量的藥物篩選,確定了一系列感興趣的、可靶向19種不同分子靶標(biāo)的先導(dǎo)化合物。在這些化合物中,有一些化合物能夠有效地對(duì)抗革蘭氏陽(yáng)性細(xì)菌,但是卻沒(méi)有一種化合物能夠?qū)垢锾m氏陰性細(xì)菌,盡管它們能夠有效地靶向從細(xì)菌中分離出來(lái)的分子靶標(biāo)。這可能是因?yàn)楦锾m氏陰性細(xì)菌的包膜具有強(qiáng)效的屏障功能,并且還包繞著多種擴(kuò)散介質(zhì)和外排介質(zhì)。
如果我們更深入地了解細(xì)菌滲透過(guò)程以及細(xì)菌孔蛋白的晶體結(jié)構(gòu),就能夠很快解決這一挑戰(zhàn)。最近推出了一項(xiàng)政府與民間合作的計(jì)劃——創(chuàng)新藥物計(jì)劃(Innovative Medicines Initiative)中的細(xì)菌細(xì)胞壁通透性分子基礎(chǔ)項(xiàng)目(TRANSLOCATION),該項(xiàng)目利用大量來(lái)自于學(xué)術(shù)界和制藥行業(yè)的資源,理解并解決了可穿透革蘭氏陰性細(xì)菌包膜的新藥的研發(fā)難題。然而,對(duì)于每一個(gè)可促進(jìn)新抗生素研發(fā)的生物學(xué)基本認(rèn)識(shí)而言,其他的認(rèn)識(shí)可能會(huì)讓人走進(jìn)死胡同里。因此至關(guān)重要的是,我們應(yīng)當(dāng)不斷深入地研究細(xì)菌生理學(xué)的其它基本問(wèn)題,例如耐藥性的發(fā)展、致病力或者與宿主免疫系統(tǒng)之間的相互作用等。我們可以利用其他方法(例如對(duì)新培養(yǎng)的細(xì)菌所產(chǎn)生的天然產(chǎn)物進(jìn)行隨機(jī)篩選),來(lái)生產(chǎn)出對(duì)抗重要病原體的先導(dǎo)抗生素,但是卻難以通過(guò)這種方法來(lái)發(fā)現(xiàn)可對(duì)抗耐受性更強(qiáng)的革蘭氏陰性細(xì)菌的抗生素。
而另一方面,在應(yīng)對(duì)耐藥性問(wèn)題時(shí),抗生素的臨床使用和開藥也能夠發(fā)揮關(guān)鍵的作用。醫(yī)生往往會(huì)憑借經(jīng)驗(yàn)來(lái)開具新廣譜抗生素(broad-spectrum antibiotics)的處方,而并沒(méi)有預(yù)先了解是哪種(或哪些)致病菌引起感染的、致病菌會(huì)對(duì)哪種(或哪些)藥物敏感,這種情況會(huì)導(dǎo)致細(xì)菌很快產(chǎn)生新藥的耐藥性。例如在美國(guó)和北歐,只有5%到10%的肺炎克雷伯氏菌(Klebsiella pneumoniae)對(duì)第三代頭孢菌素(third-generation cephalosporins)具有耐藥性,但是醫(yī)生卻懷疑這種耐藥性普遍存在,因此經(jīng)常使用碳青霉烯類抗生素(carbapenem)來(lái)治療患者(如圖)。這種做法反而導(dǎo)致重癥監(jiān)護(hù)病房中出現(xiàn)碳青霉烯類抗生素耐藥性較高的細(xì)菌。人們可能會(huì)爭(zhēng)論:由于90%的細(xì)菌感染患者可能會(huì)接受頭孢菌素的治療,因此碳青霉烯類抗生素應(yīng)當(dāng)作為第二道防線而保留下來(lái)。然而,在缺乏快速可靠的診斷技術(shù)的情況下,如果由于懷疑致病菌具有耐藥性而推遲使用碳青霉烯類抗生素的話,可能會(huì)讓感染患者失去生命。
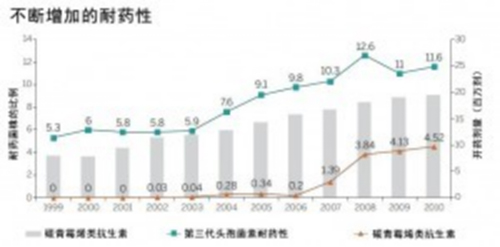
碳青霉烯類抗生素耐藥性。美國(guó)在1999年至2010年間,可耐受第三代頭孢菌素和碳青霉烯類抗生素的肺炎克雷伯氏菌所占的比例不斷增加。該圖也顯示了美國(guó)在1999年至2010年間碳青霉烯類藥物(亞胺培南(imipenen)、美羅培南(meropenem)、厄他培南(ertapenem)和多尼培南(doripenem))的累積開藥量。在這一段時(shí)期中,第三代頭孢菌素的開藥量則相對(duì)穩(wěn)定,每年大約為3000到3500萬(wàn)劑。
常規(guī)的細(xì)菌感染診斷方法包括細(xì)菌的培養(yǎng)和耐藥性檢測(cè)。盡管這種方法非常精準(zhǔn),但是需要進(jìn)行2到3天的細(xì)菌培養(yǎng)才能檢測(cè)其耐藥性,而在這段時(shí)間內(nèi),醫(yī)生還是會(huì)憑借經(jīng)驗(yàn)來(lái)治療患者。如今已經(jīng)推出了一些新的技術(shù),能夠從原始樣品中同時(shí)檢測(cè)多個(gè)致病菌和常見的耐藥基因,從而將診斷時(shí)間減少到數(shù)小時(shí)。以下措施將有助于這些技術(shù)在臨床實(shí)踐中被廣泛應(yīng)用:進(jìn)一步減少耐藥性檢測(cè)的時(shí)間,如此一來(lái),細(xì)菌感染的診斷結(jié)果就能夠指導(dǎo)醫(yī)生盡早選擇合適的藥物;對(duì)不同的生物體液或基質(zhì)進(jìn)行驗(yàn)證;進(jìn)行技術(shù)調(diào)整,以適用于中低收入國(guó)家——這些都是我們需要面臨的技術(shù)挑戰(zhàn)。而通過(guò)采取正確的激勵(lì)措施和獎(jiǎng)勵(lì),增加該研究領(lǐng)域的投資金額,就可以解決所有這些挑戰(zhàn)。NIH專門為細(xì)菌感染快速診斷技術(shù)贊助了一個(gè)獎(jiǎng)項(xiàng),該獎(jiǎng)項(xiàng)以及2014年的英國(guó)經(jīng)度獎(jiǎng)(Longitude Prize)就像一場(chǎng)及時(shí)雨,不僅促進(jìn)了這些技術(shù)的發(fā)展,同時(shí)也增強(qiáng)了醫(yī)生的意識(shí),鼓勵(lì)他們采用更理性的方法開具處方。
先進(jìn)的診斷技術(shù)將會(huì)在抗生素發(fā)現(xiàn)的早期階段為我們帶來(lái)最大的回報(bào):快速診斷技術(shù)將促進(jìn)針對(duì)性抗生素的研發(fā)和臨床應(yīng)用。廣譜抗生素研發(fā)過(guò)程中一直以來(lái)有一個(gè)“攔路虎”,就是致病菌內(nèi)部非常豐富的遺傳多態(tài)性。我們能夠更輕松地確定哪些分子可以專門靶向某種非常重要的致病菌,也更容易優(yōu)化這些分子的選擇性和耐受性,此外還能更快速地在目標(biāo)患者中進(jìn)行研發(fā)。鮑曼不動(dòng)桿菌(Acinetobacter baumannii)就是這樣一種重要的致病菌,它對(duì)現(xiàn)有的治療方法普遍具有耐藥性,可以引起較高的死亡率。而針對(duì)性很強(qiáng)的藥物價(jià)格應(yīng)該非常昂貴,因?yàn)樗鼈儗?huì)被用來(lái)治療少數(shù)病情嚴(yán)重的或無(wú)法治愈的感染患者。
如果聯(lián)合使用快速分子診斷技術(shù)和針對(duì)性抗生素的話,將會(huì)為細(xì)菌感染患者開創(chuàng)一個(gè)“個(gè)體化治療”的新時(shí)代。大多數(shù)患者可能還是會(huì)繼續(xù)服用年代久遠(yuǎn)的、至今仍然有效的廉價(jià)抗生素。快速診斷技術(shù)將有助于確定哪些患者需要服用新一代抗生素,才能夠?qū)怪虏⌒愿叩摹⒒蚓哂心退幮缘募?xì)菌,從而限制了不必要的用藥、減緩了耐藥性的出現(xiàn):總而言之,對(duì)于臨床治療和抗生素管制而言,這才是一個(gè)可持續(xù)性更強(qiáng)的做法。


